Come reagisce il sistema ormonale degli sportivi alle proteine?
L’allenamento è uno dei più forti fattori di stress per il corpo dell’atleta e influenza in modo significativo i cambiamenti nella concentrazione dei vari metaboliti circolanti nel sangue: l’elevato volume di lavoro e il carico di allenamento complessivo sono i principali fattori che influenzano l’aumento post-esercizio della secrezione di ormoni anabolici come l’ormone della crescita (GH) o l’insulina (I), che stimolano la sintesi proteica muscolare.
Il GH ha un effetto significativo sulla quota di sintesi proteica e sul tipo di substrati metabolizzati durante e subito dopo l’esercizio. Questo ormone stimola anche l’attivazione e la proliferazione delle cellule satelliti che facilitano l’ipertrofia miofibrillare. L’ormone della crescita ha un effetto anabolico sui muscoli scheletrici, stimola la sintesi delle proteine e facilita il trasporto degli aminoacidi nei muscoli scheletrici, influenzando così l’ipertrofia delle fibre muscolari di tipo I e II.
L’insulina è uno degli ormoni anabolizzanti più potenti. Esercita un effetto anabolico attraverso l’aumento della raccolta di aminoacidi nelle cellule muscolari e la stimolazione della sintesi proteica, inibendo indirettamente le reazioni cataboliche che si verificano nel corpo.
Lo stato energetico dell’organismo e l’adeguato apporto di proteine nella dieta influenzano anche la concentrazione del fattore di crescita insulino-simile (IGF-1). L’effetto anabolico di IGF-1 si basa sulla stimolazione dell’assorbimento di amminoacidi da parte dei muscoli e questo fattore ha un effetto significativo sul processo di trascrizione e traduzione della sintesi di mRNA, proteine e condromucoproteine, inibizione della proteolisi e aumento del numero di nuclei cellulari. IGF-1 stimola anche i processi di riparazione nel corpo, attiva la glicolisi, inibisce la lipolisi, stimola il sistema immunitario e inibisce l’apoptosi cellulare.
Il mantenimento della sintesi delle proteine muscolari è legato al turnover e al metabolismo delle risorse proteiche nel corpo. L’assunzione di proteine raccomandata per gli atleti è di 1,5-2 g / kg di massa corporea (BM) e in casi specifici anche di più di 3,0 g / kg di BM. Un’adeguata assunzione di proteine, nonché il tempo e il tipo di integratori alimentari utilizzati, possono avere un impatto diretto sulle risposte endocrine all’allenamento della resistenza e all’ipertrofia muscolare.
Alcuni ricercatori indicano il ruolo significativo dell’integrazione di carboidrati e proteine (CHO-PRO) e l’assunzione di varie frazioni di proteine o amminoacidi liberi prima e dopo l’esercizio nel processo di ipertrofia muscolare. Altri ricercatori suggeriscono un effetto significativo dei suddetti integratori ingeriti dopo l’esercizio e prima di andare a dormire.
Alla luce delle ultime ricerche scientifiche, le proteine del siero di latte e la caseina sono le frazioni proteiche più significative e più interagenti contenute negli integratori.
La proteina di siero di latte è la più efficiente nella somministrazione rapida di aminoacidi nel flusso sanguigno. È caratterizzato da un rapporto ottimale di aminoacidi essenziali (EAA) con una quota eccezionalmente elevata di aminoacidi a catena ramificata (BCAA) e glutammina.
Uno studio recente ha determinato l’effetto della supplementazione di carboidrati-proteine con proteine del siero di latte (CHO-PROw) dopo l’allenamento di resistenza e le proteine della caseina (PROc) prima di coricarsi sulla concentrazione di ormone della crescita (GH), insulina (I) e fattore di crescita insulino-simile (IGF-1), così come l’attività della creatina chinasi (CK).
I ricercatori hanno arruolato nello studio 12 soggetti maschi allenati (età: 25,8 ± 4,7 anni, esperienza di addestramento 6,1 ± 0,79 anni, massa corporea 75,9 ± 2,7 kg, altezza 171,8 ± 13,3 cm) e li hanno divisi casualmente in un gruppo sperimentale (gruppo E, n = 6) e un gruppo di controllo (gruppo C, n = 6).
Tutti i partecipanti allo studio hanno completato lo squat con bilanciere completo con un carico esterno costante del 90% massimo a ripetizione singola (1 RM) e un volume di 12 serie. In ogni set sono state eseguite tre ripetizioni con 3 minuti di riposo dopo ogni serie. Subito dopo il protocollo di esercizio, i soggetti del gruppo sperimentale hanno ricevuto un complesso di carboidrati-proteine (CHO-PROw) con una dose di 0,5 g / kg di massa corporea, mentre prima di coricarsi hanno ingerito un supplemento proteico (PROc) composto al 90% proteine della caseina con una dose di 0,3 g / kg di peso corporeo.
I risultati riportano un aumento significativo della concentrazione di GH nel gruppo sperimentale tra il livello di pre-esercizio e dopo 24 ore di recupero (p <0,01), nonché tra 1 ora e 24 ore di recupero (p <0,01). Livelli significativamente più elevati di GH sono stati trovati anche tra il gruppo di controllo e il gruppo sperimentale 24 ore dopo l’esercizio (p <0,01). I risultati hanno mostrato livelli significativamente più elevati di IGF-1 in ambito sperimentale rispetto al gruppo di controllo dopo 24 ore di recupero (p <0,05). Nel caso dell’insulina, non sono state osservate differenze significative nel confrontare i livelli prima dell’esercizio, dopo l’esercizio, dopo 1 ora di recupero e dopo 24 ore di recupero.
Gli integratori non hanno ridotto il danno alla membrana muscolare post-esercizio, come evidenziato dall’attività sierica della CK.
L’assunzione di questi integratori dopo esercizio di resistenza ad alta intensità ha causato un aumento della concentrazione di GH e IGF-1, che potrebbe stimolare l’ipertrofia muscolare e inibire la proteolisi.
Autori: Wilk M, Michalczyk M, Gołaś A, Krzysztofik M, Maszczyk A, Zając A.
Fonte: Biol Sport. 2018 Dec;35(4):399-405. doi:
La moderna medicina si avvale di studi scientifici di biochimica, biofisica e neurofisiopatologia dell’organismo umano che forniscono una idea dello stato di salute della persona come un equilibrio di più sistemi al fine di inquadrare il soggetto in maniera completamente personale, in una ottica di prevenzione più che di cura di una specifica malattia o di un sintomo particolare.
Questo perché ai nostri giorni sono le complesse patologie e sindromi che caratterizzano l’epoca in cui viviamo e la quotidianità delle nostre frenetiche vite a portare il soggetto a ricercare una risoluzione che abbia questo tipo di approccio.
In tutti questi disturbi la ricerca ha portato ad identificare come soggetto unificante la cosiddetta “infiammazione cronica di basso grado”.
Il nostro ipotalamo si occupa di elaborare tutti i tipi di informazione che si ricevono, coscienti e non coscienti, fisici ed emotivi, con lo scopo di preservare la funzionalità del nostro organismo. Induce pertanto a seguito di uno stress l’ipofisi a liberare una cascata di molecole che si comportano come ormoni o come citochine(specifici segnalatori del sistema immunitario) o neurotrasmettitori. Una volta attivato questo asse stimolerà direttamente il surrene con attivazione di ormoni che permettono una risposta di adattamento dell’organismo a una condizione potenzialmente pericolosa.
Da qui la necessità di distinguere due tipi di stress:
- uno stress acuto, porta ad una attivazione del sistema in una ottica “salvavita”
- uno stress cronico, che porterà a una risposta non più efficace e salvavita ma afinalistica e di sovvertimento patologico dei sistemi. Questa liberazione di molecole, in tal caso, corrisponderà alla condizione di infiammazione cronica silente d basso grado, che potrà comportare per attivazione cronica a patologie cardiovascolari, ipertensione, ulcere, sovrappeso, malnutrizione, neuroinflamaging, disbiosi intestinale, alterazioni dell’umore, delle funzioni cognitive.
In questa ottica un evento specifico periferico come una emozione, uno stato metabolico ottimale, uno stato fisico muscolare riequilibrato, uno stato ormonale riequilibrato diventerà fonte di riequilibrio degli altri sistemi .
Il dott. Mark Mattson, direttore del laboratorio di neuroscienze presso la John Hopkins University è uno dei più importanti ricercatori nel campo dei meccanismi cellulari e molecolari alla base di molte malattie neuro degenerative, come il Parkinson e il morbo d’Alzheimer.
È noto da molto tempo che i cambiamenti della dieta possano influenzare il funzionamento cerebrale. La sovralimentazione può inficiare l’attività dell’ipotalamo, che svolge un ruolo fondamentale per il controllo del bilancio energetico dell’organismo. Uno studio sul digiuno intermittente, ovvero i digiunare per periodi brevi di tempo, ha messo in evidenza come è in grado di migliorare memoria e apprendimento e di ridurre i rischi di degenerazione delle funzioni cerebrali.
Sia il digiuno che l’esercizio fisico, infatti aumentano il numero di mitocondri (ossia gli organelli cellulari deputati alla produzione di energia) nei neuroni. In questo modo non solo migliora a funzione cognitiva, ma aumenta la resistenza allo stress e riduce le infiammazioni.
Durante una restrizione calorica o un digiuno vero e proprio, viene ammantata la produzione di una proteina detta fattore neurotofico (BDNF) che si pensa sia la chiave della produzione di mitocondri.
Inoltre on pochi studi affermano come lo stesso digiuno abbia effetti incredibili anche sulla protezione del sistema immunitario, stimolando il rinnovamento delle cellule deputate a questa funzione.
Generalmente in palestra la storia è questa, si segue la scheda con precisione, gli esercizi vengono svolti in ordine e si guarda spaccato il cronometro per riprendere la serie successiva. Fin qui tutto bene; arrivato il momento dello stretching tanti saluti !! Quelle 4-5 posture di “allungamento muscolare” (prendiamo per adesso questa frase per buona) a fine workout non si reggono proprio e vengono rimandate a chissà quando.
Il problema è che spesso tra i frequentatori delle palestre e centri fitness non passa il messaggio di quanto lo stretching sia fondamentale. In un certo qual modo si intuisce che possa far bene “a qualcosa” ma viene del tutto ignorato il legame imprescindibile che c’è tra l’allungamento muscolare (e di tutti i tessuti molli ad esso annessi) e l’ipertrofia muscolare. Magari il Grosso della palestra storcerà il naso denigrando questa attività, dicendovi “Io non faccio mai stretching e guarda… Sono enorme”. Ok bravo. Peccato poi lo vedete fare mezzi squat (spesso al multipower… già non servirebbe aggiungere altro) con una mobilità articolare pari a quella di vostro nonno in carrozzina !! Senza poi considerare il discorso doping, ormai diffusissimo anche tra gli amatoriali; magari possono fare a meno dello stretching ma non di bucarsi il di dietro… Ma non vorrei divagare.
Senza essere troppo prolisso e noioso e dato che di didietro si parla, vi dirò come mai lo stretching e l’ipertrofia sono, in sintesi, come “Culo e camicia”, perdonate il francesismo.
DUE PAROLE SULLA FISIOLOGIA
Il nostro corpo conseguentemente ad una programmazione regolare di esercizi di stretching subisce diversi cambiamenti, oltre che nel muscolo stesso anche al livello degli altri tessuti molli come tendini, legamenti ed epidermide che cominceranno via via ad adattarsi all’allungamento a cui vengono sottoposti.
Tutto ha inizio al livello sarcomerico, ovvero l’unità contrattile del muscolo; quando un certo muscolo comincia ad allungarsi le sovrapposizioni tra gli stretti e spessi filamenti che costituiscono i sarcomeri, chiamati miofilamenti, vanno via via diminuendo. Al momento della massima lunghezza dei sarcomeri la fibra muscolare raggiunge la sua massima estensione a riposo.
Andando oltre con la pratica dello stretching andremmo ad indurre un allungamento del tessuto connettivo e delle guaine muscolari. Nel corso del tempo, eseguendo questa attività con costanza, aumenteranno le serie di sarcomeri e questi ultimi andranno ad aggiungersi alle stremità delle miofibrille già esistenti che a loro volta aumenteranno la complessiva lunghezza del muscolo e del range di movimento. Di conseguenza:
Aumentando il nostro range di movimento aumentiamo l’escursione percorribile dai nostri arti senza provocare danni ai muscoli o tendini. In altri termini maggiore sarà la flessibilità ed elasticità dei muscoli e tessuti molli maggiore sarà la probabilità che portiamo al termine il nostro esercizio in palestra senza che lo sforzo provochi danni e stiramenti muscolari.
Aumentando la lunghezza muscolare aumentiamo la distanza attraverso cui è possibile la contrazione muscolare. Ciò conduce ad un potenziale incremento della nostra potenza muscolare, ad un maggior controllo motorio e dell’equilibrio dinamico.
Ed ecco che arriviamo al punto chiave !!!!
Un incremento della lunghezza muscolare e del range articolare comportano quindi un’esecuzione più completa dell’esercizio preso in questione con conseguente MAGGIOR STIMOLO ANABOLICO per la muscolatura.
Ma un’immagine vale più di mille parole.
 L’uomo che vediamo squattare con una montagna di ferro sulle spalle si chiama Tom Platz (sicuramente molti di voi lo conoscono) ed è un noto campione della cosiddetta “Old School” diventato famosissimo per le sue gambe del tutto straordinarie e per la sua tecnica di allenamento. L’accosciata è così profonda che sembra quasi che quel bilanciere pesi come un manico di scopa, ma la realtà è ben diversa. Quest’uomo eseguiva degli squat ad una profondità pazzesca, “sedere a terra”, in relazione ad un carico di centinaia di kili sul groppone.
L’uomo che vediamo squattare con una montagna di ferro sulle spalle si chiama Tom Platz (sicuramente molti di voi lo conoscono) ed è un noto campione della cosiddetta “Old School” diventato famosissimo per le sue gambe del tutto straordinarie e per la sua tecnica di allenamento. L’accosciata è così profonda che sembra quasi che quel bilanciere pesi come un manico di scopa, ma la realtà è ben diversa. Quest’uomo eseguiva degli squat ad una profondità pazzesca, “sedere a terra”, in relazione ad un carico di centinaia di kili sul groppone.
Queste immagini secondo me esplicano al meglio ciò di cui si parlava sopra….
Come potete pensare di fare uno squat completo, stile powerlifter o addirittura weightlifter, senza una buona elasticità femorale? L’alternativa? fare mezzi squat con 300 kili? Bisogna fare stretching !! Non si scappa !! Guardate Platz come pone in allungamento i muscoli del della catena cinetica posteriore (l’immagine a sinistra), in particolar modo ischiocrurali e lombari, essenziali per un perfetto squat sotto il parallelo… e davvero tale squat provoca uno stimolo ipertrofico pazzesco!! Avrete dei bellissimi doms per giorni e giorni. Ora non voglio certo dirvi che basta fare l’aratro yoga come Tom Platz per squattare più di 200 kili per 23 ripetizioni (non ci crederete forse ma quest’uomo è stato capace di compiere quest’impresa titanica, andatelo a vedere su youtube se vi va) ma indubbiamente i benefici arriveranno. Ad onor del vero voglio però ricordare che i campioni di bodybuilding sono farmacie ambulanti quindi non voglio certo fomentare “false speranze ipertrofiche” ma confido che abbiate capito il nesso del discorso.
Autore: Jacopo Senesi – Fisioterapista – Personal Trainer
E-mail: senesi.fisio@gmail.com
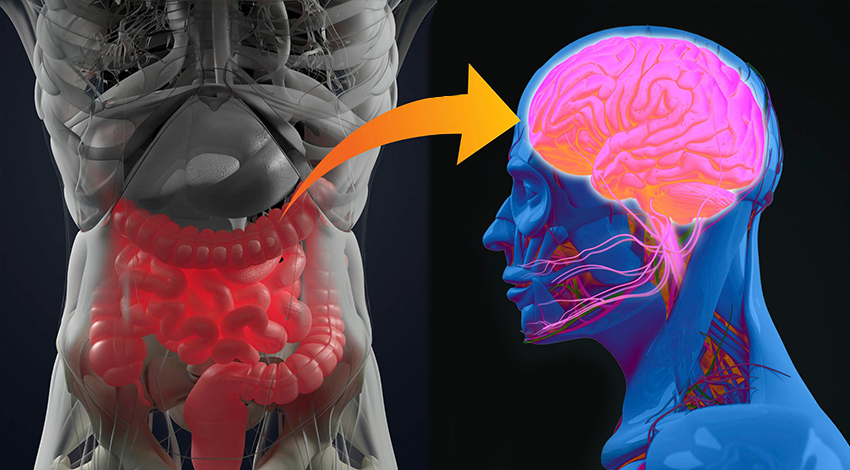
Partendo dall’intuizione dell’anatomopatologo tedesco Braak, un gruppo di ricercatori della Johns Hopkins ha messo a punto un modello murino, che l’ha confermata in pieno. Il Parkinson avrebbe origine nell’intestino, dove si formerebbero aggregati della proteina patologica alfa-sinucleina che poi risalirebbero, come per una scala, sfruttando le terminazioni dal nervo vago, verso le aree cerebrali dove si trovano i neuroni produttori di dopamina (subtantia nigra), determinandone così la morte. Riuscire a bloccare la risalita di queste proteine verso il cervello nelle fasi precoci di malattia, potrebbe significare prevenire o arrestare la progressione del Parkinson
La notizia viene da uno studio pubblicato su Neuron a firma di Sangjune Kim e colleghi del Johns Hopkins Medicine ed è rivoluzionaria. Alcuni esperimenti condotti su modelli animali (topi) dimostrano che il Parkinson origina da alcune cellule dell’intestino, per poi risalire, attraverso il nervo vago, fin nel cervello per andare a colpire i neuroni produttori di dopamina. Questa straordinaria evidenza offre alla scienza un modello accurato e innovativo sul quale testare trattamenti che potrebbero prevenire o arrestare la progressione di questa malattia.
“Questo studio – afferma Ted Dawson, direttore del Johns Hopkins Institute for Cell Engineering e professore di neurologia alla Johns Hopkins – fornisce ulteriori evidenze del ruolo che l’intestino gioca nel morbo di Parkinson e costituisce allo stesso tempo un nuovo modello per studiare la progressione di questa malattia, fin dalle primissime fasi”.
Alfa-sinucleina ‘mal ripiegata’: la proteina patologica alla base del Parkinson
La caratteristica anatomopatologica del Parkinson sono gli aggregati di forme mal ripiegate della proteina neuronale alfa-sinucleina e la morte selettiva dei neuroni produttori di dopamina in una piccola regione del cervello, la pars compacta della substantia nigra. La moria dei neuroni di quest’area determina i sintomi motori del Parkinson (tremori, rigidità, movimenti rallentati, turbe dell’equilibrio, alterazioni del linguaggio e della coordinazione). Non esistono al momento terapie risolutive.
I primi studi sull’origine intestinale del Parkinson
Lo studio appena pubblicato ha le sue radici nelle ricerche del neuroanatomista Heiko Braak che nel 2003 aveva dimostrato come le persone con Parkinson presentino degli accumuli della proteina alfa-sinucleina incorrettamente ripiegata (misfolded) in alcune zone del sistema nervoso deputate al controllo dell’intestino. La comparsa di queste proteine danneggia-neuroni coincide con il riscontro di alcuni sintomi precoci del Parkinson, quali la stipsi. Braak aveva ipotizzato che la malattia di Parkinson progrediva ‘risalendo’, come lungo una scala, lungo i nervi che collegano l’intestino al cervello.
Da allora si sono andate accumulando sempre più evidenze dell’esistenza di una connessione intestino-cervello, alla base di questa malattia. Alcune ricerche hanno dimostrato che le proteine alfa-sinucleina mal ripiegate fossero in grado di risalire verso la base del cervello, attraverso il nervo vago.
Gli esperimenti della Johns Hopkins: iniezioni di alfa-sinucleina nell’intestino e resezione del nervo vago
Partendo da questa base, i ricercatori della Johns Hopkins hanno iniettato 25 microgrammi di alfa-sinucleina ‘malripiegata’ nell’intestino di una dozzina di topi in buona salute. A distanza di 1, 3 , 7 e 10 mesi dall’iniezione, i ricercatori americani sono andati ad analizzare dei campioni di tessuto cerebrale dei topi, evidenziando così che l’alfa-sinucleinasi andava accumulando nelle terminazioni intestinali del nervo vago per poi diffondersi in varie zone del cervello.
Gli autori dello studio sono andati quindi a ripetere l’esperimento (iniezione di alfa-sinucleina mal ripiegata a livello intestinale) utilizzando animali ai quali era stato reciso il nervo vago. A distanza di sette mesi, gli animali non mostravano alcun danno a livello cerebrale; la conclusione dei ricercatori è stata dunque che la recisione del nervo vago impediva la diffusione verso il cervello della proteina patogena.
In un’altra parte dell’esperimento, i ricercatori sono andati a valutare la corrispondenza tra progressione della malattia e alterazioni comportamentali, esaminando tre gruppi di animali: topi iniettati con alfa-sinucleina mal ripiegata, topi iniettati con la proteina patologica e ai quali veniva sezionato il nervo vago, gruppo di controllo (topi non iniettati e con nervo vago integro).
A distanza di sette mesi dall’iniezione di alfa-sinucleina gli autori dello studio sono andati a valutare la capacità di costruire una tana da parte degli animali, fornendo loro 2,5 grammi di materiale adatto e osservandoli per 16 ore; alla capacità ‘costruttiva’ veniva quindi assegnato un punteggio da 0 a 6. I topi iniettati e con nervo vago intatto sono risultati quelli con la peggior attitudine alla costruzione di un rifugio (il loro punteggio era costantemente inferiore a 1, mentre gli animali degli altri due gruppi totalizzavano 3 o 4); a differenza degli altri due gruppi che utilizzavano sempre tutto il materiale ‘da costruzione’ fornito, i topi iniettati con alfa-sinucleina misfolded ne utilizzavano meno di un grammo. Questo esperimento – commentano gli autori – sta a dimostrare che questi animali, esattamente come avviene nell’uomo, con la progressione della malattia presentano un deterioramento del controllo dei movimenti fini.
Un altro esperimento è andato a misurare i livelli di ansia dei topi, monitorando la loro reazione ad un nuovo ambiente. Il topo veniva posto in una grande scatola aperta dove una telecamera monitorava costantemente la loro capacità di esplorazione. I topi in salute si mostravano curiosi ed esploravano ogni parte del nuovo ambiente; quelli affetti da declino cognitivo al contrario erano più ansiosi e tendevano a rifugiarsi verso i bordi coperti della scatola, più che ad esplorarne il centro. Secondo i ricercatori anche questo tratto ansioso è caratteristico dei pazienti con Parkinson.
Le ricadute dello studio: verso una terapia per il Parkinson
I risultati di questo studio dimostrano dunque che l’alfa-sinucleina mal ripiegata nei topi si può ‘trasmettere’ dall’intestino al cervello, risalendo il nervo vago; il blocco di questa via di comunicazione potrebbe aiutare secondo gli autori di questa ricerca a prevenire le manifestazioni fisiche e cognitive del Parkinson e potrebbe dunque rappresentare un target terapeutico per le prime fasi della malattia. Resta però da scoprire quali parti del nervo vago consentono la risalita delle proteine patologiche verso il cervello e come bloccarla.
Autore: MR Montebelli – Fonte: MR Montebelli
L’influenza della frequenza e della tempistica dei pasti sulla salute e sulle malattie è stata un argomento di interesse per molti anni.
Mentre le evidenze epidemiologiche indicano un’associazione tra le più alte frequenze del pasto e il più basso rischio di malattia, prove sperimentali hanno mostrato risultati contrastanti. Inoltre, recenti ricerche prospettiche hanno dimostrato un aumento significativo del rischio di malattia con un’alta frequenza del pasto (≥6 pasti al giorno) rispetto a una bassa frequenza del pasto (1-2 pasti al giorno). Oltre alla frequenza e ai tempi del pasto, dobbiamo considerare anche il consumo della colazione e la distribuzione dell’apporto energetico giornaliero, la restrizione calorica e il consumo notturno. Un ruolo centrale in questo scenario complesso è giocato dalla durata del periodo di digiuno tra due pasti. Il sottofondo fisiologico di queste variabili interconnesse può avvenire attraverso orologi circadiani interni e il consumo di cibo asincrono con i ritmi circadiani naturali può esercitare effetti negativi sulla salute e aumentare il rischio di malattia. Inoltre, le alterazioni nella frequenza dei pasti e nei tempi dei pasti hanno il potenziale di influenzare l’assunzione di energia e macronutrienti. Un modello regolare di pasti incluso il consumo della prima colazione, consumando una più alta percentuale di energia all’inizio della giornata, riduce la frequenza del pasto (cioè 2-3 pasti al giorno ), e periodi di digiuno regolari possono fornire benefici fisiologici quali riduzione dell’infiammazione, miglioramento della ritmicità circadiana, aumento dell’autofagia e resistenza allo stress e modulazione del microbiota intestinale.
Nella cultura occidentale, è un’idea comune che l’assunzione giornaliera di cibo dovrebbe essere divisa in tre pasti quadrati: colazione, pranzo e cena. Spesso i dietologi suggeriscono di aggiungere due spuntini (mattina e pomeriggio) per aiutare il controllo dell’appetito, e in effetti il messaggio principale è quello di mangiare “da cinque a sei volte al giorno”. Tuttavia, il numero di pasti non è uno standard universale, e i tre pasti quadrati tradizionali sono, in qualche modo sorprendentemente, un comportamento recente. Ad esempio, gli antichi romani avevano solo un sostanzioso pasto, di solito consumato intorno alle 16:00 (coena), e credevano che mangiare più di una volta al giorno fosse malsano. Sebbene mangiassero anche al mattino (ientaculum) ea mezzogiorno (prandium), questi pasti erano frugali, leggeri e veloci [1]. Più tardi, le regole monastiche influenzarono il comportamento alimentare delle persone comuni. Il termine colazione significa “interrompere la notte veloce”, sottolineando che si tratta del primo pasto dopo la serata / serata dedicata alla preghiera [2]. Nei primi tempi medievali, i monaci erano obbligati a rimanere in silenzio durante i pasti, mentre uno di loro leggeva ad alta voce un testo religioso. Uno dei testi più letti è stato il Collationes (compilation) di Giovanni Cassiano, e vale la pena ricordare che il termine italiano per colazione è “colazione”, che deriva proprio dalla parola latina “collationes” [3]. Anche la colazione è diventata importante durante la rivoluzione industriale come pasto consumato prima di andare al lavoro. La cena nella sua forma attuale e il suo tempo sono diventati popolari dopo l’uso diffuso della luce artificiale, che ha facilitato il consumo prima dell’alba e dopo il tramonto [3].
Fonte: Antonio Paoli, Grant Tinsley, Antonino Bianco and Tatiana Moro
Un gruppo di ricercatori coordinati da Saverio Minucci, Direttore del Programma Nuovi Farmaci dell’Istituto Europeo di Oncologia e Professore Ordinario di Patologia Generale dell’Università degli Studi di Milano (in collaborazione con il gruppo di Marco Foiani, Direttore Scientifico dell’IFOM e Professore Ordinario di Biologia Molecolare dell’Università degli Studi di Milano), ha scoperto un inedito meccanismo molecolare in grado, se attivato, di far morire “di fame” le cellule tumorali. I risultati della ricerca, sostenuta da Fondazione AIRC per la ricerca sul cancro, appaiono sulla prestigiosa rivista scientifica Cancer Cell.
Si tratta di una nuova strategia per combattere il cancro attaccando il suo metabolismo alterato. I ricercatori hanno scoperto che una dieta che porti a un abbassamento della glicemia, associata alla somministrazione di metformina, innesca una reazione a catena che, coinvolgendo la proteina PP2A, porta alla morte delle cellule tumorali. La metformina è un farmaco ben noto e ampiamente utilizzato contro il diabete di tipo II. Nello studio sono stati già coinvolti altri centri che avvieranno a breve studi clinici.
Nella sperimentazione clinica dovrà essere confermata la tollerabilità della combinazione e inoltre in via preliminare si dovrà valutare l’efficacia della combinazione di una dieta ipoglicemica e metformina per fermare la progressione del tumore, in aggiunta a terapie già in uso come la chemioterapia.
Studi precedenti hanno già dimostrato che i pazienti in terapia chemioterapica tollerano bene sia la riduzione glicemica, sia l’assunzione di metformina.
«Si sa da circa un secolo che il metabolismo è una delle differenze chiave fra la cellula cancerosa e quella sana – spiega Minucci – e quindi deve essere possibile uccidere le cellule malate sfruttando questa differenza. La cellula usa due processi per generare energia: la glicolisi, che si basa sulla disponibilità di glucosio, e la fosforilazione ossidativa, che può essere inibita con la metformina. Noi abbiamo pensato di attaccare il metabolismo mirando al fenomeno della “plasticità metabolica”, vale a dire la strategia con cui la cellula cancerosa si adatta, passando dalla glicolisi alla fosforilazione ossidativa e viceversa, in condizioni di mancanza di nutrimento. Nel nostro studio, riducendo il tasso glicemico con la dieta e somministrando metformina, abbiamo inibito la plasticità metabolica e abbiamo fatto morire le cellule tumorali. Ma siamo andati oltre, scandagliando il meccanismo dell’effetto sinergico di dieta e metformina. Grazie a una dettagliata analisi funzionale a livello molecolare, abbiamo scoperto che ciò che fa morire la cellula tumorale è l’attivazione della proteina PP2A e del suo circuito molecolare. Questo è un dato importante non solo dal punto di vista scientifico, ma anche utile per la clinica. Ipotizziamo infatti che i pazienti che presentano una mutazione in questo circuito potrebbero non rispondere alla futura terapia con dieta e metformina».
«Siamo nelle condizioni di avviare immediatamente studi clinici – conclude Minucci – e questo passaggio così rapido è molto raro nel passaggio dalla ricerca di base alla clinica, ed è per noi motivo di grande soddisfazione e di aspettativa per gli sviluppi futuri».
Fonte: Comunicato stampa